在医疗器械开发过程中,确保产品与人体的兼容性是保障安全性和有效性的关键步骤。然而,在实际操作中,开发者往往会面临测试项目之间交叉干扰、顺序难定、影响难以预测等“先有鸡还是先有蛋”的悖论局面。本篇文章将从细菌内毒素、生物负载、无菌性、生物相容性、清洁度、无菌屏障、加速老化与生产环境八个维度,梳理这些测试间的关键联动逻辑,并结合虚构设备“Gluco-Quick”(快速注射血糖的装置)为例进行分析,提供一套可供参考的整合测试策略。

人机兼容性要素关系总览
多项测试维度之间往往存在非线性联动:某项变更不仅可能影响自身,还可能引发其他因素的重新验证。这种复杂性决定了测试顺序不能完全线性化处理。以下为各要素关系概览:
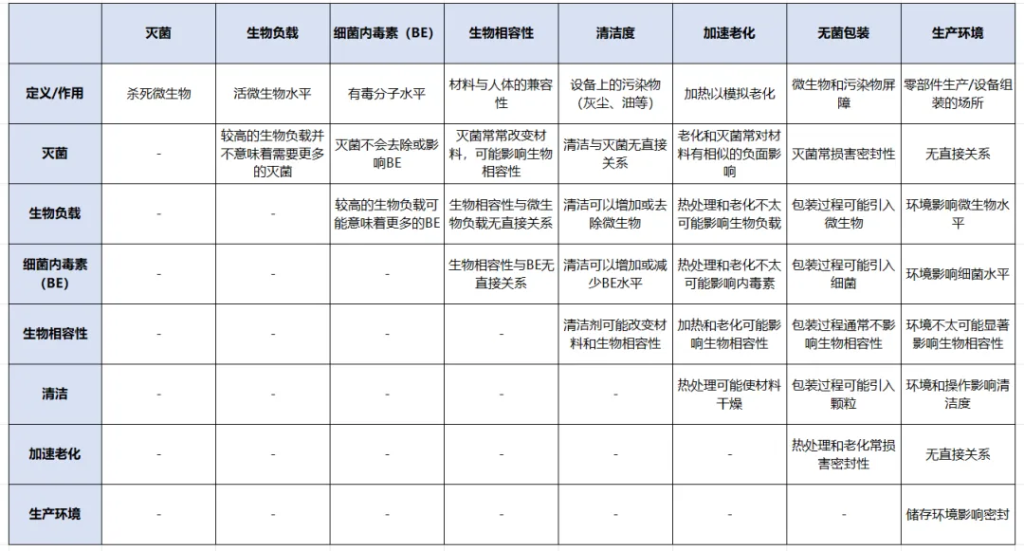
(注:上图和下文仅为概述,并未涵盖所有潜在变量、设备实例或场景。)
关键测试维度详解与Gluco-Quick案例
细菌内毒素(Bacterial Endotoxins)
- 定义:革兰阴性菌死亡后释放的毒性物质,极微量即可引发发热、炎症甚至感染性休克。
- 重要性:与体液或组织接触的器械必须检测细菌内毒素,特别是心血管及脑脊液相关产品限值最严。
- 检测方法:标准方法为鲎试剂(LAL)检测法,依据ANSI/AAMI ST72标准。
- 案例:假设Gluco-Quick内含针头和注射器,需在注册及量产阶段进行内毒素限值确认与持续监控。
无菌性与生物负载(Sterility and Bioburden)
- 无菌性:通过蒸汽、气体或辐射杀灭活体微生物。
- 生物负载:未经灭菌产品表面的微生物数量,决定灭菌剂量和方式。适用标准为ISO 11737系列。
- 注意:尽管无菌和细菌内毒素是相关的,但灭菌≠无毒,灭菌能杀死细菌,但并不能去除其释放的内毒素。
- 案例:Gluco-Quick采用伽马射线灭菌,须先测定生物负载,再设计辐照方案并验证。
生物相容性(Biocompatibility)
- 标准与内容:按ISO 10993-1评估材料与人体的接触反应,考虑直接接触或通过体液间接作用。特殊产品如呼吸机,需参照ISO 18562-1标准。
- 注意事项:材料可能在灭菌后性能改变,因此更保守的做法是用灭菌后样品进行测试。
- 案例:Gluco-Quick含有大量塑料,应以灭菌后样本进行生物相容性测试。材料本身不影响内毒素,除非更换为支持微生物生长的材料。
清洁度(Cleanliness)
- 定义:通常是指通过化学或机械方法去除灰尘、油污等污垢。清洁要求取决于器械的应用场景。
- 注意事项:清洁虽可去除微生物、内毒素和有害化学物,但有时清洁过程反而可能引入污染。因此,在进行最终的细菌内毒素、无菌性和生物相容性测试之前,务必完善所有清洁流程。
- 测试流程建议:应在完成清洁工艺定义后,再进行内毒素、无菌性和生物相容性测试。
- 案例:Gluco-Quick将葡萄糖注入血液,需要确保材料足够洁净以满足标准(如USP 788)。
无菌屏障(Sterile Barrier)
- 定义与作用:无菌屏障通常为密封包装(托盘、袋等)或其他形状,作用是阻挡微生物与污染物进入。在许多情况下,它们还允许空气进出,以防止压力积聚,并方便气体灭菌。无菌屏障是整体器械包装的一个组成部分,但它们并不等同。
- 联动关系:无菌屏障可能影响生物负载、清洁度与内毒素,偶尔影响生物相容性;灭菌强度过高可损伤密封性。
- 案例:Gluco-Quick采用成型塑料托盘与Tyvek盖膜。包装工艺确定前,不应进行内毒素、生物负载和清洁度测试。建议先盖装置以降低包装处理干扰。
加速老化(Accelerated Aging)
- 方法说明:采用ASTM F1980标准,Q10理论(每升10℃,反应速率翻倍)模拟老化,如一个月的热处理可以模拟大约一年的老化过程,从而支持设备快速上市。
- 风险与影响:热处理可能直接影响材料特性(包括生物相容性),也可能通过损坏无菌屏障间接影响。热量还会蒸发残留物、清洁剂或润滑剂。未能充分考虑热处理影响,可能导致测试结果无效,造成时间和经济损失。
- 案例:热处理后发现Gluco-Quick葡萄糖粘度下降并泄漏,因此更换橡胶密封为金属活塞环,导致需重新测试:内毒素、生物负载、灭菌、生物相容性、清洁度。
生产环境(Production Environment)
- 涵盖因素:包括组装工艺、温湿度、空气质量、仓储与人员管理等,涉及零部件生产与成品储存。
- 影响维度:生产环境会对生物负载、细菌内毒素和清洁度产生巨大影响,并且会因(紫外线)辐射、温度和湿度对无菌屏障产生一定影响。
- 案例说明:更换密封件后,Gluco-Quick设计测试通过,但销售预测增加需扩建产线,导致重新开展生物负载、内毒素与清洁度测试。
最终整合策略(以Gluco-Quick为例)
- 测试与葡萄糖接触的所有部件:检测内毒素、确认灭菌兼容性;
- 测试生物相容性与清洁度;
- 建立生产环境与包装流程:开展生物负载测试并完成灭菌验证;
- 成品测试:对成品再次测试内毒素、生物相容性与清洁度,确保先前的策略足以降低风险。
总结
人机兼容性的多个维度之间存在复杂关联,这种非线性关系使得“测试顺序”成为一场悖论。虽然风险无法完全消除,但合理规划测试顺序是控制风险的关键。
参考内容来源:https://www.mpo-mag.com/exclusives/navigating-the-paradoxes-of-human-compatibility-testing/
关于我们
索特医疗是一家国际化医疗器械 CDMO 公司,拥有成熟的全球研发和制造网络。公司在爱尔兰和美国设有研发中心,在亚太地区设有大型制造中心。索特专注于导管、导丝、医用内窥镜、手术机器人和其他产品领域,在心脑血管以及消化、呼吸和其他临床领域创新产品的设计、开发和生产方面积累了丰富的经验。我们利用充分协同的网络,为全球医疗设备制造商提供最具经济效益和响应速度的服务。








